Pembrolizumab(Keytruda)與nivolumab(Opdivo)為anti T cell PD-1 antibody,接上後抑制T cell的煞車器,讓他永保活性,活化免疫,殺死癌細胞。健保適應症多為晚期癌症,如:
1.
黑色素細胞瘤
腫瘤無法切除或轉移之第三~四期黑色素瘤病人,先前曾接受過至少一次全身性治療失敗者。
KEYNOTE-006
2 mg/kg q3w IF 20 min直到疾病惡化(PD),或無法接受毒性反應
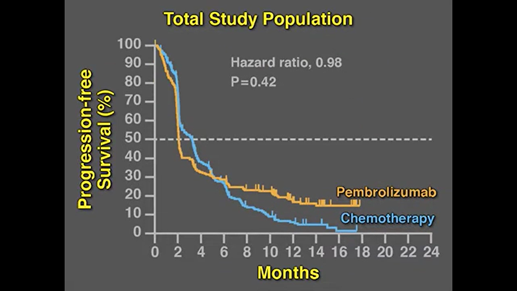
pembro vs ipilimumab,PFS分別是4.1m月,與2.8月,3-4級ADR也是pembro較低
https://pubmed.ncbi.nlm.nih.gov/31345627/
KEYNOTE-006 post hoc
pembrolizumab 10 mg/kg i.v. Q2-3W until PD or ipilimumab 3 mg/kg Q3W for up to four doses
OS: 32·7 months (95% CI 24·5-41·6) in the combined pembrolizumab groups and
15·9 months (13·3-22·0) in the ipilimumab group (HR 0·73, CI 0·61-0·88, p=0·00049)
PFS: 8·4 months (95% CI 6·6-11·3) in the combined pembrolizumab groups versus
3·4 months (2·9-4·2) in the ipilimumab group (HR 0·57, 95% CI 0·48-0·67, p<0·0001)
https://reurl.cc/g0EaDQ
trial PN006
pembrolizumab 10 mg/kg i.v. Q2-3W until PD or ipilimumab 3 mg/kg Q3W for up to four doses
OS: Q2W arm: HR = 0.63; CI, 0.47-0.83; P < 0.001;
Q3W arm: HR = 0.69; CI, 0.52-0.90; P = 0.004
PFS: Q2W:4.1 vs Q3W:5.5 vs ipi 2.8月
Restricted mean PFS time (RMPFST) was
5.4 months (95% CI, 4.7–6.0), 5.8 months (95% CI, 5.1–6.4),
and 3.6 months (95% CI, 3.2–3.4) in the pembrolizumab
2 mg/kg, 10 mg/kg, and control arms
PN002
pembrolizumab 2 or 10 mg/kg i.v. Q3W or to investigator's choice of chemotherapy
2.
非小細胞肺癌stage3, meta, unresectable (*一線藥)
ž 單獨使用,用於不適合化療(通常是副作用CTCAE≧2),第一線治療腫瘤高度表現PD-L1 (tumor proportion score (TPS) ≥ 1%)的轉移非小細胞肺癌患者,且不具EGFR或ALK基因異常者。
ž 與pemetrexed及carboplatin併用,應先給keytruda,做為轉移性,不具EGFR或ALK基因異常之非鱗狀非小細胞肺癌的第一線治療藥物。
200 mg q3w or 400mg q6w IF 20 min直到PD,或無法接受毒性反應,或24個月無PD則停藥
不適合化療:
l CTCAE v4.0 grade≧2 audiometric hearing loss
l CTCAE v4.0 grade≧2 peripheral neuropathy
l CIRS (the cumulative illness rating scale) score >6
3.
典型何杰金氏淋巴瘤
治療罹患頑固性或先前至少已接受三種治療仍復發之患者。
200 mg q3w or 400mg q6w IF 20 min直到PD,或無法接受毒性反應,或24個月無PD則停藥
4.
頭頸部鱗狀細胞癌meta, unresectable (*一線藥)
治療在使用platinum類化療期間或治療後出現疾病惡化的復發或轉移性頭頸部鱗狀細胞癌的患者。只能與cetuximab擇一使用。
200 mg q3w or 400mg q6w IF 20 min直到PD,或無法接受毒性反應,或24個月無PD則停藥
KEYNOTE 040: 復發或轉移之頭頸癌病患,經含鉑類藥物治療無效後的第三期RCT(第二線治療):
Pembrolizumab vs標準二線治療[Methotrexate、Docetaxel或Cetuximab三選一],存活時間(mOS)預設p值必須<0.0175才有統計差異,結果當時的mOS分別是8.4個月(Pembrolizumab) vs. 7.1個月(標準治療)(p=0.0204),無法證明免疫治療優於標準治療;不過在2018年的AACR大會發表的分析則獲得平反,mOS為8.4個月(Pembrolizumab) vs. 6.9個月(標準治療)=顯著差異。
OS有多2個月左右
5.
泌尿道上皮癌
治療接受含鉑化學治療期間或治療後出現疾病惡化現象的局部晚期或轉移性泌尿道上皮癌患者。或是不適合化療者。
200 mg q3w or 400mg q6w IF 20 min直到PD,或無法接受毒性反應,或24個月無PD則停藥
KEYNOTE
045pembro vs standard chemo: OS有顯著多3個月, PFS沒差。 pembro副作用較少,肺炎、膽道炎與腸炎
6.
胃癌
治療患有復發性局部晚期或轉移性胃腺癌或胃食道接合部腺癌,經確認有PD-L1表現(綜合陽性分數[Combined
Positive Score, CPS]≥1),且先前曾在使用兩種(含)以上之療法(包括含有fluoropyrimidine及platinum化療,以及HER2/neu標靶療法[如果適合])治療時或治療後出現疾病惡化現象的病人。
200 mg q3w or 400mg q6w IF 20 min直到PD,或無法接受毒性反應,或24個月無PD則停藥
7.
原發性縱膈腔B細胞淋巴瘤
治療罹患頑固性或先前至少已接受兩種治療仍復發之原發性縱膈腔B細胞淋巴瘤的成人及兒童病人。 使用限制:不建議對立即需要細胞減量治療之原發性縱膈腔B細胞淋巴瘤病人使用KEYTRUDA
8.
高微衛星不穩定性(microsatellite instability high; MSI-H)或錯誤配對修復功能不足性(mismatch
repair deficient; dMMR)癌症 治療患有無法切除或轉移性之下列癌症的成人病人。
使用fluoropyrimidine, oxaliplatin及irinotecan治療後出現惡化現象的大腸直腸癌,或於先前治療後出現惡化現象且無任何其他適當之替代治療選擇的實體腫瘤。
9.
高微衛星不穩定性或錯誤配對修復功能不足性大腸直腸癌(*一線藥) 做為無法切除或轉移性病人的第一線治療藥物。
10.
肝細胞癌
治療先前經sorafenib治療的肝細胞癌 (HCC)病人
11.
子宮頸癌
治療經確效之試驗檢測出腫瘤有PD-L1表現 (CPS≥1),且在接受化學治療期間或治療後出現疾病惡化現象的復發或轉移性子宮頸癌病人。
12.
腎細胞癌(*一線藥) 與axitinib併用,做為晚期腎細胞癌病人的第一線治療藥物。與lenvatinib併用,做為晚期腎細胞癌病人的第一線治療藥物。
13.
子宮內膜癌 與 lenvatinib 併用適用於曾經接受過全身性治療後疾病惡化,且不適合根治手術或放射治療的不具有高微衛星不穩定性(microsatellite instability-high, MSI-H)或錯誤配對修復功能不足(mismatch repair deficient,dMMR)之晚期子宮內膜癌病人。
14.
食道癌(*一線藥) 與含鉑及fluoropyrimidine之化學療法併用,做為局部晚期無法切除或轉移性食道癌或胃食道接合部癌病人的第一線治療藥物。 治療患有復發性局部晚期或轉移性食道鱗狀細胞癌,腫瘤有PD-L1表現( [CPS]≥10) 病人,且先前曾接受一種(含)以上全身性治療,於治療時或治療後發生疾病惡化的病人
15.
三陰性乳癌(Triple Negative Breast Cancer) 與化學療法併用,治療局部復發性無法切除或轉移性之三陰性乳癌(TNBC),腫瘤有PD-L1表現( [CPS]≥10)病人。
16.
高腫瘤突變負荷量(Tumor Mutational Burden-High; TMB-H)癌症
治療患有無法切除或轉移性、經確效之試驗檢測出高腫瘤突變負荷量(tumor mutation burden high [TMB-H]) [≥10 mutations / megabase
(mut/Mb)]、於先前治療後出現惡化現象且無任何其他適當替代治療選擇之實體腫瘤的成人病人。
常用劑量為:100mg/4ml/vial
黑色素瘤2 mg/kg q3w.
其他癌症多為200 mg q3w 或 400 mg q6w.
取需要的藥量(ml) in NS or D5W 最終濃度1-10mg/ml IV infusion 30 min
需使用0.2-0.5 ![]() m的filter,或用 TPN set(含filter),不可於同一line給其他藥物
m的filter,或用 TPN set(含filter),不可於同一line給其他藥物
發生下列反應(irAE),即應暫時停用直到症狀回復至0-1級:
第2級肺炎、ILD(AST,ALT,bili)(immune
mediated pneumonitis)…..給prednisolone 1-2mg/kg/day
第2或3級結腸炎腹瀉(immune mediated colitis)…..給prednisolone 1-2mg/kg/day
第2級內分泌病變,包含腦下垂體炎、甲狀腺炎、D1TM(ketoacidosis)(immune
mediated endocrinopathies)給steroid horomone tx,
propylthiouracil (PTU)或methimazole或beta blocker
第2級腎炎(immune mediated nephritis)…..給prednisolone 1-2mg/kg/day
AST or ALT 3倍~5倍ULN,或總膽紅 素1.5~3倍ULN (immune mediated hepatitis ) 給prednisolone 0.5-1 mg/kg/day。小心B,C肝復發
任何其他的重度或第3級治療相關不良反應 (SJS, TEN…皮膚症狀、心肌炎、)
下列任一反應,即應永久停用:
任何危及生命的不良反應
第3或4級肺炎或復發(recurrent)第二級肺炎
第3或4級腎炎
AST或ALT>5倍ULN或總膽紅素>3倍ULN或AST、ALT較基礎值升高≧50%,且持續至少1週
第3或4級輸注相關反應
無法在12週內將steroid降低至prednisone每日10mg (含)以下
持續的第2或3級不良反應,且未能於投予最後一劑KEYTRUDA後的12週內回復至第0-1級
任何再度發生的重度或第3級治療相關不良反應
對胎兒毒性,懷孕禁用。最後一劑4個月內不要哺乳與懷孕
常見副作用
皮膚副作用:蕁麻疹(11~28%)。
內分泌副作用:高膽固醇血症(20%)、高血糖(40~48%)、高三酸甘油脂血症(23~25%)、白蛋白低下(32~34%)、鈉離子低下(10~38%)。
胃腸道副作用:便秘(15~51%)、食慾不振(16~31%)、腹瀉(14~37%)、噁心(13~68%)。
肝臟副作用:鹼性磷酸酶上升(26%)、肝指數上升(20~24%)。
骨骼肌副作用:關節疼痛(10~18%)、骨骼肌疼痛(21~32%)。
呼吸道副作用:咳嗽(15~24%)、呼吸困難(11~39%)。
其它:疲倦(20~71%)。
少見但嚴重之副作用
心血管副作用:免疫相關血管炎(<1%)。
皮膚副作用:天皰瘡(<1%)。
內分泌副作用:腦下垂體炎(<1%)。
血液副作用:嚴重貧血、溶血性貧血。
肝臟副作用:肝炎、肝靜脈閉鎖。
骨骼肌副作用:橫紋肌溶解。
神經學副作用:認知混亂。
眼科副作用:視神經炎。
腎臟副作用:免疫性腎炎。
呼吸道副作用:肋膜腔積水、肺炎、呼吸衰竭。
其它:輸注反應。
致吐等級
極低。