一、鏈黴素的發現與產權糾紛
全世界第一個AMG是從放線菌(Actinomycete)身上分離出來的streptomycin(鏈黴素)~
那是個抗生素大發現的時代(1940s-1960s),許多生物化學家從各種細菌、真菌身上提煉、分離抗菌物質轉作藥用。
位於美國紐澤西州歷史悠久的拉特格斯大學(Rutgers University)的微生物系系主任
塞爾曼·瓦克斯曼(Selman Waksman)與其碩士學生 阿爾伯特·沙茨 (Albert
Schatz)、伊麗莎白·布吉 (Elizabeth Bugie) 於1943年從土壤細菌-放線菌綱的灰色鏈黴菌 (Streptomyces griseus)中分離出鏈黴素,是第一個用來治療TB的抗生素,因此系主任於1952年獲得諾貝爾生理醫學獎,同時享有高額的專利費用,但與碩士生之間的發明專利貢獻值糾紛搞得糜糜卯卯爭議不斷,也顯示了1952年的女權真的挺糟糕的~
Waksman的實驗室總共分離出了actinomycin, clavacin, streptothricin, streptomycin, grisein,
neomycin, fradicin, candicidin, candidin~
之後其他人陸續從各種鏈黴菌中分離出AMG
l Streptomycin (1943, S. griseus)
l neomycin (1949, S. fradiae)
l kanamycin (1957, S. kanamyceticus)
l gentamicin (1963, Micromonospora
purpurea)
l sisomicin (196x, Micromonospora inositola)
l netilmicin (1967, derived from sisomicin)
l tobramycin (1967, S. tenebrarius)
l amikacin (1972, derived from kanamycin)
二、AMG的藥理學-機轉與適應症
1.
抑制蛋白質合成
2.
中斷蛋白合成
3.
合成錯誤的蛋白
但其實AMG進入細胞的過程也是重要的:
l GPC因為厚重的肽聚糖細胞壁阻擋AMG穿透;
l GNB外層膜有porin channel,中層細胞壁單薄可透,內膜有類似ATPase的pump,建立H+濃度梯度後AMG與H+一起打進細胞質(耗氧耗能主動運輸)。AMG也可以取代掉穩定外膜的Ca、Mg離子,讓外膜破掉,以進入細胞
基於上述機轉,二價陽離子、高滲透壓、酸性環境(如肺部/支氣管分泌物中,pH<6.5)、缺氧環境(如abscess膿瘍又酸又缺氧),都會降低藥效。
因為酸性環境含大量H+或是高滲透壓,會抑制ATPase建立濃度梯度,或缺氧無法行耗氧的主動運輸,淨結果是AMG無法被送進細胞質中,殺菌效果↓,細菌MIC上升。
l 所以AMG主力用來打G-,特別是MDR GNB(後線藥物)
雖然有效,但因為聽、腎毒性高,通常保留到後線使用,是謂七傷拳
l 對上G+需要搭配破壞細胞壁的beta-lactam才能順利進到細胞質作事(協同作用-synergic
effect)。
l 對分支桿菌效果也不錯
l 厭氧菌環境缺氧無法主動運輸,AMG沒效
治療上通常合併其他抗生素使用,少數可單用的情境如下:
l 兔熱病(Tularemia,病原為土倫病法蘭西斯氏菌Francisella
tularensis) :一線用藥Gentamicin, ciprofloxacin
l 鼠疫(Plague, 病原為鼠疫耶氏桿菌Yersinia
pestis):一線用藥Streptomycin , gentamicin, FQs
l
MDR GNB UTI: 因為~100%原型腎排,尿中高度濃縮,殺菌效果很好
l 淋病(病原為N. gonorrhoeae):一線為ceftriaxone,doxycycline,替代選擇如azithromycin,
gentamicin
三、副作用
1.
腎毒性:藥物由腎絲球過濾後,長時間高Trough濃度累積在近曲小管上皮細胞,造成發炎、缺氧、凋亡、壞死(acute tubular necrosis, ATN),初期電解質與水分流失,後面會嚴重發炎腎小管阻塞+腎動脈收縮,造成嚴重AKI (好在是可逆的)。
2.
聽毒性:長期高trough濃度累積於耳蝸毛細胞,結合上裏頭的粒腺體12S rRNA→毒性複合物大肆破壞,產生自由基,核醣體、高基氏體死亡、毛細胞無法合成ATP,啟動細胞凋亡→不可逆耳聾 (先從高頻音喪失)。
*若有粒線體12S rRNA (MTRNR1) gene 的m.1555A>G突變者(台灣),無法產生較高濃度的帶正電耳蝸淋巴液,帶正電的AMG就能輕易累積於耳蝸淋巴液,且該粒腺體與AMG親和力更高,較高機率產生毒性
3. 神經肌肉阻斷:機轉作用於細胞內的抗生素較有機會神經肌肉阻斷,透過抑制節前神經(pre-synapse)細胞膜上的鈣離子進出通道,減少神經傳遞物質(acetylcholine)的分泌,節後神經得不到訊號,肌肉無法收縮,故重症肌無力者應避免使用 (AMG, Macrolide, FQs…)
四、動力學 和
藥效學
|
藥物動力學 |
|
|
吸收 |
水溶性高,帶電荷,沒有特殊transport channel可以從腸道吸收 l IV使用為主 (30-60min達peak,需再經過30min重分布進細胞間質) l IM (60-90min達peak) l 口服吸收差,neomycin PO可用於外科手術前預防腸道菌感染、hepatic
encephalopathy (殺死腸道菌,減少氨生成) l 其他如外用藥膏、IV拿來吸入、IP、IT |
|
分布 |
l Protein binding: 0-10% l Vd=0.2-0.4L/kg (平均0.26L/kg x lean body weight,幼兒、水腫、腹水、燒傷、嚴重感染則Vd↑、肥人則↓要乘ABW) l 穿透性差: n 腦膜正常CSF/serum:
<10% n 腦膜發炎CSF/serum: <25%
(但<MIC) n 肺部上皮內襯液(Epithelial
lining fluid)濃度/serum: 10-20% 所以單用效果差,只有UTI可單用 l 腎小管細胞、腎臟間質濃度/serum:
20-30x l 尿液中濃度/serum: 25-100x
>>MIC |
|
代謝 |
幾乎不被代謝 |
|
排除 |
l 99%原型腎排(≒腎絲球過濾率CCr),<1%糞便與唾液 l K=0.00293xCCr+0.014 l 半衰期:2.5hr (成人與>6個月嬰兒,正常腎)、17-150hr (ESRD) l 各種洗腎都可以洗掉:high flux
HD, SLEED洗50%(20-65%)、low flux HD洗30%、CAPD(30-50%)、CVVH (看流速決定) |
|
藥效學 |
|
|
Concentration
dependent |
Peak > 8-10X MIC才有較好的殺菌力 |
|
假說:可能濃度高容易穿透細胞膜,然後target較多,越濃能接合上越多target產生PAE。而time-dept如penicillin binding
protein可能容易飽和,更多β-lactam無法增加效果,反而長時間抑制PBP效果更好。 l
新的抗生素為哪種dept無法單純從機轉推估,只能用看看才知道。 |
|
|
Post-antibiotic
effect (PAE) |
定義:藥物進入細胞中,扒住30S不放,即便血中濃度已經<MIC還是有一段時間有殺菌力 l For GNB: 2-6hr(1.2-12.8hr),濃度越高越久、neutropenia者更短(中性球可加強胞吞作用) l For GPC:幾乎沒有PAE |
|
Once
daily dose (ODD) |
QD大劑量的用法,如gentamicin
5-7mg/kg QD、amikacin 15mg/kg QD(嚴重sepsis, septic shock Vd↑可拉到25mg/kg) l 基於AMG為conc. dept,peak >8-10X MIC殺菌效果好 l 因為有PAE,所以血中濃度<MIC一段時間還行,但也不是無限有效,頂多撐到QOD,再長就會有太多時間體內沒有殺菌效果而治療失敗。 l QD給藥trough可以較低,減少累積產生腎/聽毒性 |
五、TDM
1.
確定適應症,選擇藥物與目標濃度
AMG在GNB尤其是MDR GNB通常要給較高劑量,如amikacin給once daily dose 15mg/kg QD(需腎調),目標peak20-25以上(8-10x MIC)。但若只是協同其他抗生素,通常用gentamicin1.7mg/kg Q12H(需腎調),目標peak 3-4
2. 選擇劑量與給
AMG有兩種給藥方法:
l Multiple daily dosing, MDD(又稱Traditional dosing)
l Once daily dosing , ODD(又稱High - dose
extended-interval dosing)
|
選擇ODD的理由: l AMG毒性與trough有關 l AMG療效與peak有關,為Concentration dependent又有PAE: n peak拉到該細菌的8-10倍MIC殺菌效果才好,單次高劑量容易達成。
n QD給就有效,是因為PAE。AMG的PAE較長約2-6hr,所以才能使用ODD給法。但也不是無限有效,頂多撐到QOD,再長就會有太多時間體內沒有殺菌效果而治療失敗。 |
|
但可惜不是所有人都能用ODD,以下情況大部分paper或資料庫都建議改用傳統給法: 因為Vd增加 (故難以達到高peak):
3.
腹水>20%TBW (嚴重肝病) 4.
CCr<20(40)(腎功能不穩定、AKI、爛腎或洗腎) 5.
>20%燒燙傷 6.
ICU重症患者常常需要hydration,體內Vd變大 7.
Cystic fibrosis 另外,GPC也不太使用ODD,因為可能沒有PAE,QD給會有長時間無治療濃度 另一個簡單的理由就是一堆研究將這些人排除掉,所以不知道效果。排除的理由可能是預期藥物濃度會很亂影響研究品質。 |
舉例:
60kg 160cm成年男性,校正CCr 60,用Amikacin for PsA
TBW=60kg
IBW=(160-80)*0.7=56kg
ABW=IBW+0.4(TBW-IBW)=57.6…
對一位正常體態者,選哪種體重差異不大,care療效就選TBW,care毒性就選IBW (也聽過有人是都選IBW,總歸都是預測劑量,之後抽血做TDM才是正解),肥胖者才選用ABW
ODD:
15mg/kg=900mg QD
傳統給法:
先給予一劑amikacin Loading dose(7.5mg/kg=450mg),整數調至 500mg後,因他CCr60,照下表MD可以調成450 x 71%=320 mg Q8H或380mg Q12H,我個人建議用Q12,整數調成400mg Q12H
*注意:本表為校正CCr=[(140-age)/Scr] (女x0.85),僅適用於成人
3.
抽血檢驗
AMG使用>5天者,或有AKI風險者,皆應抽血做TDM
l ODD:
理論上每次QD後trough會掉到0,不會累積,故每劑都是穩定態,第二劑前就可抽trough。通常peak會很高>MIC 8-10x,不太需要抽peak,若細菌MIC高會擔心想抽也可以。
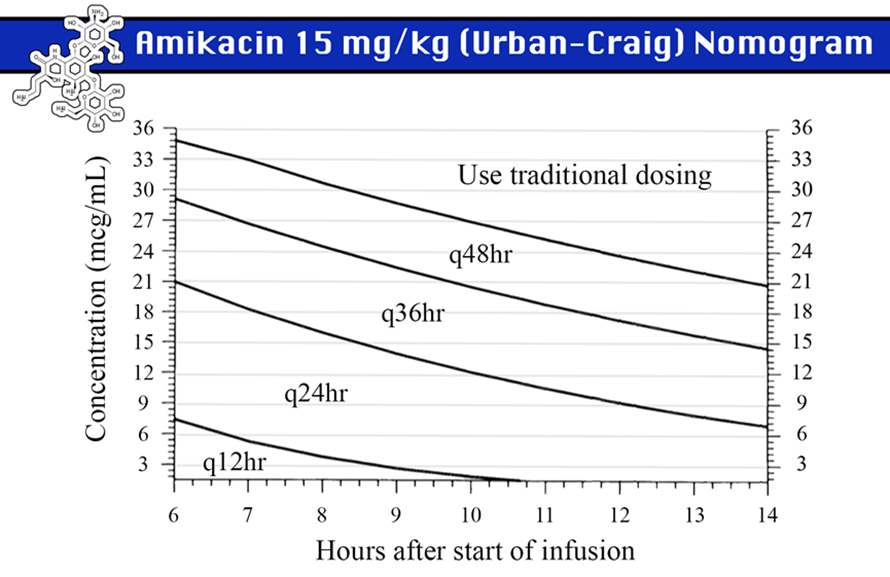
下圖為1995年Nicolau et al做出的AMG的normogram,在genta 剛好給5mg/kg, 7mg/kg; amikacin 剛好給15mg/kg時,可以抽6-14hr血中濃度,來決定這個劑量應該給何種頻次。
n 缺點: 劑量要給剛好她說的數字才準,如果落於Q36hr會很尷尬…
l MDD: 一般好腎成人t1/2=2.5hr,所以3-5個半衰期約半天達穩定態,但沒抽濃度前不知道半衰期,只好抓3個劑量後抽第4劑給藥前trough,第4劑30min輸注完後再等30min抽peak濃度—利用兩點濃度回推true peak &true trough看是否達到目標值
|
濃度達標 |
後續監測腎功能CCr, U/O,穩定則1 周測一次trough即可 |
|
|
濃度過高 |
若超過太多+有腎毒性 |
hold until濃度降至目標區間(利用兩點濃度劑算得的半衰期),再以新劑量給藥 |
|
若超過不多且無毒性 |
直接換成新的劑量 |
|
|
濃度過低 |
視情況給LD=(C目標-C現在)xVd |
|
|
給新劑量後都要在下次穩定態時,再次抽血做TDM |
||
l CVVH病人
CVVH的病人要單靠amikacin達到完美的濃度是非常困難的,給法眾說紛紜,但通常建議要有其他抗生素輔助,不可以單打獨鬥。
可以先嘗試LDEI的調整劑量15mg/kg Q24-48H,輸注完後30-60min抽peak(目標細菌MIC的8-10倍)、給藥前抽trough(目標<2)。通常tough會太高,再按比例調低劑量或頻次。但我這時就會問醫師,療效與副作用,你目前最希望哪個先達到? 無論哪個都記得要先給loading dose 15mg/kg
如果首要療效,我們就先試 15-25mg/kg Q48H
如果要少副作用,我們先7.5mg/kg QD (選擇這個,trough可以放寬到<8)
雖說已爛腎不擔心,但trough太高,可能惡化AKI,這會惡化後續腎功能恢 復 (retrospective cohort研究發現嚴重AKI、HF、並用腎毒性藥物如vancomycin, colistin,acyclovir...這些會惡未來化腎功能的恢復)
另外,高trough也會擔心聾掉
----------------------------
不管是怎樣的病人,使用AMG拿來殺GNB,目標一般都是細菌處藥物peak≧8-10XMIC 、血中trough<2-8(看你是用LDEI還是傳統給法)、給藥間隔最多到48hr(有人用到Q72H,但這樣多半效果差),所以如果細菌長在尿中,正常腎功能者會在尿中濃縮AMG達到夠高的peak劑量就可以給低一點;相反的AMG在肺部epithelial lining fluid濃度不足+該處酸性環境下AMG效果變差,就要更高一點的劑量。
----------------------------
可以把CVVH當成病人有一個CCr 40左右的腎臟(要看CVVH開的流速),監測方式依樣是輸注完後30-60min抽peak、給藥前抽trough
LDEI又稱為once daily dose (ODD),概念是需要夠高的peak與夠低的trough,如果腎功能不好的人(如CCr<20-40),高peak可以達到,但排除不夠所以低trough較難達成,除非你給Q48H甚至Q72H,但這樣會使得濃度<MIC的時間太久。一般來說Aminoglycoside即便血中濃度<MIC還能維持一小段殺菌時間(稱為post antibiotics effect),但頂多2-12hr就是極限了(正比於peak濃度),所以頻次間隔太久療效就不會太好
* 洗腎病人(HD、CVVH、SLED都一樣),分布體積↑所以很難達到高peak、清除率↓很難達到低trough,所以許多指引都建議改用傳統劑量
standford的給藥指引 (不是熱病) p.6 是建議給傳統劑量10mg/kg loading, then 7.5mg/kg Q24-48H。
peak目標15-35、trough<4-8

















沒有留言:
張貼留言