病例探討
疑似ceftriaxone導致急性胰臟炎
摘要
急性胰臟炎
(Acute pancreatitis, AP) 在台灣平均年發生率約每10萬人36.9件,1誘發因子包括膽結石、酗酒、藥物、內視鏡逆行性膽胰管攝影
(Endoscopic retrograde cholangiopancreatography, ERCP)、高血鈣、高三酸甘油脂…等。其中20%會演變成嚴重AP,包含胰臟壞死、敗血症、器官衰竭,死亡率為20-40%,2因此儘早診斷出AP並阻斷可能的誘發因子十分重要,本文將透過分享一例疑似ceftriaxone導致的AP,來介紹臨床上常使用並可能誘發AP的藥物,以及其治療處置。
關鍵字:急性胰臟炎
(Acute pancreatitis)、ceftriaxone、膽結石
(Cholelithiasis)
案例簡介
一名82歲女性,過去病史有第四期慢性腎病、May-thurner
syndrome於2009、2013年裝左側髂靜脈支架,並定期回診追蹤。本次主訴為雙腳紅腫疼痛持續一星期而住院,於2023/9/8經社區診所檢查並無骨折,9/9因疼痛難以忍受來到急診,當下生命徵象正常、下肢水腫4+,經醫師診斷為下肢蜂窩性組織炎,並給予Ceftriaxone
2g IV QD (9/9-10/2)。
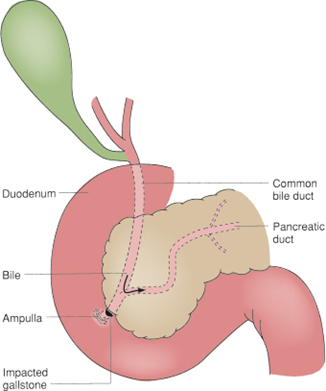
病人於9/25晚間劇烈腹痛 (VAS: 5/10),醫師開立Strocain (Oxethazaine 5 mg + Polymigel 244 mg) 1TAB PO、Tramadol 100 mg IV,疼痛緩解 (VAS: 3/10)。隨即測得 amylase: 2212 U/L, lipase: 9277 U/L,醫師診斷為AP,並開始禁食,但無停止使用ceftriaxone。後續腹部超音波與電腦斷層發現疑似膽道結石或膽砂。除Ceftriaxone外病人所使用藥物皆與過去門診相同,可排除其他藥物可能。根據仿單以及文獻,Ceftriaxone 10-20%由膽汁排除,可能與其中的鈣形成不可溶之鈣鹽阻塞膽管,導致AP。相關案例報告為用藥後 2周與6周後發生,3,4此病人為第15天,具時序相關,因為Ceftriaxone 90%與血中白蛋白結合,此病人白蛋白低下可能導致游離態藥物增加,加上病人本身有第四期慢性腎病,藥物因腎排除降低,轉而由膽汁排除,增加膽管阻塞,引發AP之風險。之後雖Ceftriaxone繼續使用,但禁食加輸液補充後,腎功能、amylase與lipase皆有改善。於10/2停止使用Ceftriaxone後,lipase也有降低之趨勢。
綜合以上述,雖不能排除病人入院後飲食導致AP的可能,但考慮到仿單及文獻與病人狀況符合,且停用Ceftriaxone後三天lipase數值有降低之趨勢,仍懷疑本次事件為腎功能不良與白蛋白低下時使用Ceftriaxone而導致的AP。
表一、病人住院相關檢驗值
|
檢驗項目 |
9/ 21 |
22 |
25 |
27 |
10/ 2 |
5 |
|
Amylase (28-100 U/L) |
|
|
2212 |
559 |
294 |
|
|
Lipase (13-60 U/L) |
|
|
9277 |
196 |
203 |
157 |
|
Creatinine (0.7-1.2 mg/dL) |
1.84 |
|
1.87 |
1.59 |
1.69 |
1.99 |
|
Albumin (3.7-5.3g/dL) 9/9 3.4 |
|
|
2.9 |
|
|
|
|
Calcium ( 8.6~10.0 mg/dL) |
|
|
8.7 |
7.5 |
8.3 |
|
|
Triglyceride (<150 mg/dL) |
|
|
69 |
98 |
|
|
用藥評估與討論
一、急性胰臟炎簡介與發生率
AP的誘發因子包含膽結石、酗酒、抽菸、藥物、ERCP、高血鈣、高三酸甘油脂、感染、基因、自體免疫與外傷。其中以膽結石
(佔40-70%)
與酗酒
(佔20-35%)
為最主要原因,藥物則相對少見,僅佔約0.1-2%。5其發生率因地而異,高收入國家如美國,年發生率為每十萬人4.9-35件,且逐年增加,可能與肥胖與膽結石比率增加有關。根據奇美醫院沈修年醫師的健保資料庫研究,1從2000到2009年台灣首次發作之AP年發生率幾乎穩定維持每10萬人36.9件,其中兒童
(<15歲)、老年人
(≥65歲)
與膽道阻塞相關的AP比率增加,酒精性AP比率維持,而15-64歲男性的比率則減少。62%
AP患者有合併症,如肝病、消化性潰瘍及糖尿病,會增加重症與死亡風險。
正常胰臟會分泌各種不具活性的消化酶原 (如胰蛋白酶原trypsinogen),經由胰管和Oddi括約肌分泌到十二指腸中,被腸激酶 (enterokinase) 活化後始得消化養分。如果酶原在離開胰臟前過早被活化,則可能對周邊組織自我消化造成發炎壞死。胰臟有多種機制可避免如此情況發生,如分泌胰蛋白酶抑制劑 (trypsin inhibitor) 可結合並抑制20%的胰蛋白酶活性、分泌胰凝乳蛋白酶 C (Chymotrypsin C) 分解在胰臟中不正常活化的胰蛋白酶等。6
AP的致病機轉有很多理論,比如病人膽結石塞住總膽管出口,可能使膽汁逆流進胰管,引發胰臟酶原活化造成傷害,這是最常見導致AP的原因。其次是酒精濫用,可能導致胰臟腺泡細胞 (acinar cell) 對膽囊收縮素的過度敏感和提早的酶原活化,或是誘導腺泡細胞過度產生酵素,積聚滯留於胰腺內而過早活化。另外,三酸甘油脂過高,乳糜微粒可能快速累積導致胰臟微循環缺血,加上乳糜微粒三酸甘油酯 (chylomicron
triglyceride) 酯化,會產生非酯化遊離脂肪酸 (nonesterified free fatty acid) 可能導致發炎介質和自由基的釋放,傷害胰臟。
其他誘發因子多半是活化蛋白酶分解胰臟組織,造成發炎、血管通透性增加,引發出血、水腫、缺血和壞死。此時腺泡細胞會大量分泌澱粉酶(amylase)與脂肪酶(lipase)超過正常值的3倍, 典型的症狀為急性劇烈上腹痛,經常描述為如刀割一般並放射至後背,且疼痛會因走路與平躺而加重,患者會想坐起並向前拳曲。其他症狀如噁心嘔吐、發燒、黃疸,重症患者可能因腹膜後出血產生兩肋皮下瘀斑 (Grey Turner’s sign)
或臍周瘀斑 (Cullen’s sign),併發發燒、呼吸急促、低氧血、低血壓、胰內血栓、血管破壞及實質內出血等症狀。多數嚴重併發症於發病後 48 小時內發生,包括局部和系統性症狀。局部併發症包括液體積聚、胰臟假性囊腫 (pseudocyst)、壞死積聚 (necrotic collection) 和封閉性壞死 (walled off necrosis)。液體和壞死組織積聚可能會繼發性感染,導致全身性發炎反應症候群 (Systemic inflammatory
response syndrome, SIRS) 和敗血症 (Sepsis)。全身性併發症包括內臟靜脈血栓、腹部腔室症候群、假性動脈瘤、急性呼吸窘迫症候群、冠狀動脈疾病和慢性肺部疾病等潛在合併症的惡化。
AP的預後,嚴重度與死亡率可以使用Ranson criteria來預測 (如表一),區分成膽結石相關AP與非膽結石相關AP,藥物引發的AP屬於後者。每個項目佔一分,0~2分:死亡率2%、3~4分:死亡率15%、5~6分:死亡率40%、7~8分:死亡率 100%
|
Ranson
(膽結石相關) |
Ranson
(酒精等非膽結石相關) |
|
發病當下 |
|
|
>70歲 WBC>18000/mm3 LDH >250 U/L AST >250 U/L 血糖 >220 mg/dL |
>55歲 WBC>16000/mm3 LDH >350 U/L AST >250 U/L 血糖 >200 mg/dL |
|
發病48小時內 |
|
|
Hct 下降 > 10% BUN 升高 > 2 mg/dl 血鈣 < 8 mg/dL 動脈血氧 PO2 < 60mmHg 鹼缺乏 > 5 mEq/L 體液流失 > 4 L |
Hct下降 > 10% BUN升高 > 5 mg/dl 血鈣<8 mg/dL 動脈血氧 PO2 < 60mmHg 鹼缺乏 > 4 mEq/L 體液流失 > 6 L |
亞特蘭大分類(Atlanta classification)將AP依嚴重程度分為兩類:間質性水腫性急性胰臟炎 (interstitial and edematous acute pancreatitis) 和壞死性急性胰臟炎 (necrotizing acute pancreatitis)。前者屬於輕症胰臟實質和胰週發炎而不壞死,後者為重症發炎和廣泛壞死,併發胰內血栓、血管破壞及實質內出血,同時存在一個或多個持續性器官衰竭。
二、藥物導致急性胰臟炎的致病機轉5
藥物導致AP並不常見,發生率約0.1-2%,診斷需要先排除常見的膽石性AP和酒精性AP,以及其他阻塞的可能,如胰頭腫瘤。並監測amylase、lipase、三酸甘油酯、血鈣、肝功能的變化,若停藥後數值有改善,復藥後惡化,則該次發作與藥物較為相關,但基於倫理因素,再次嘗試使用同樣藥物的機率較低,因此多數可疑藥物無法確定與AP的關聯性。依照案例報告數量、用藥後的發病時間及在次給藥後的反應,許多人統計了藥物導致AP的可能性,分成classI~IV,I與II級最為可能,本篇節錄2020年Wolfe等人製作的分類表,如表二。9
|
Class Ia |
|
|
至少1例再次給藥呈陽性的病例報告,排除所有其他原因,如酒精、高三酸甘油脂血症、膽結石和其他藥物。 |
5-aminosalicylic acid、Mercaptopurine、Acetaminophen、All-trans retinoic acid、Azathioprine、Bezafibrate、Captopril、Carbimazole、Cimetidine、Codeine、Dapsone、Erythromycin、Fluvastatin、Furosemide、Interferon alpha、Isoniazid、L-asparaginase、Lisinopril、Metformin、Methimazole、Methylprednisolone、Metronidazole、Nitrofurantoin、Orlistat、Piroxicam、Pravastatin、Prednisone、Premarin、Procainamide、Ramipril、Ranitidine、Rosuvastatin、Simvastatin、Sorafenib、Sulindac、Tamoxifen、Telaprevir、Tetracycline、Thalidomide、Trimethoprim-sulfamethoxazole、Vemurafenib、Valproic acid |
|
Class Ib |
|
|
至少1例再次給藥呈陽性的病例報告;但無法排除其他原因所致。 |
Amiodarone, Ampicillin,
Carbamazepine, Ciprofloxacin, Clomiphene, Clozapine, Cytarabine,
Dexamethasone, Didanosine, Diphenoxylate+atropine, Enalapril, Everolimus,
Growth Hormone, Hydrochlorothiazide, Hydrocortisone, Ifosfamide, Lamivudine,
Losartan, Mefenamic acid, Meglumine antimoniate, Methyldopa, Mirtazapine,
Nelfinavir, Octreotide, Omeprazole , Oral contraceptive, Paclitaxel,
Pentamidine, Perindopril, Prednisolone, Propofol, Quetiapine, Rifampicin,
Risperidone, Saxagliptin, Sulfasalazine, Tigecycline, Valsartan, Voriconazole |
|
Class Ic |
|
|
至少一例人類案例,無再次給藥,但有排除其他原因 |
Amoxicillin +
clavulanic acid, Artesunate, Atorvastatin, Axitinib, Boceprevir, Bortezomib,
Canaglifozin, Candesartan, Celecoxib, Clarithromycin, Danazol, Diclofenac,
Diethylstilbestrol, Dilantin, Dimethyl fumarate, Doxycycline , Ezetimibe,
Finasteride, Flurbiprofen , Gadolinium, Glicazide, Glimepiride, Ibuprofen,
Interferon beta, Indomethacin, Irbesartan, Itraconazole, Ketoprofen,
Ketorolac, Lenvatinib, Liraglutide, Minocycline, Naltrexone, Naproxen,
Nilotinib, Olanzapine, Pantoprazole, Propylthiouracil, Sirolimus,
Theophylline, Tinidazole, Vildagliptin |
|
Class II |
|
|
至少4個案例,一致的用藥到發病延遲時間(≥75%的案例) |
Ceftriaxone、Clofibrate、Exenatide、Isotretinoin、Levetiracetam、Sitagliptin |
|
Class III |
|
|
至少2個案例,案例之間的發病延遲不一致,沒有再次給藥 |
Acetylsalicylic acid、Gold、Nivolumab、Ondansetron、Tacrolimus |
|
Class IV |
|
|
藥物不屬於先前描述的類別,僅發表過單次案例報告,沒有再次給藥 |
Ado-Trastuzumab
emtansine, Albiglutide, Alendronate, Benazepril, Calcium carbonate,
Capecitabine, Cisplatin, Clonidine, Ertapenem, Estramustine phosphate,
Famcyclovir, Gatifloxacin, Gemfibrozil, Granisetron, Interleukin-2,
Lacosamide, Lamotrigine, Linagliptin, Linezolid, Lixisenatide, Loperamide,
Lovastatin, Micafungin, Montelukast, Mycophenolate mofetil, Norfloxacin,
Pazopanib, PEG-based bowel cleanser, Pregabalin, Rasburicase, Rifamipin,
Ritonavir, Stavudine, Sunitinib, Tacalcitol, Telmisartan, Tocilizumab,
Ursodeoxycholic acid, Venlafaxine, Zidovudine, Ziprasidone |
藥物導致AP可能的機轉包含多種因素,如促Oddi括約肌過度收縮 (鴉片類藥物)、具細胞毒性 (diuretics, sulfonamides)、有毒代謝物或中間體的累積 (valproic acid, pentamidine, minocycline, tetracycline)、產生氧化自由基 (metronidazole, valproic acid)、膽泥沉澱或結石阻塞膽管、造成胰臟缺血 (diuretics, azathioprine)、具粒線體毒性(nuclear reverse transcriptase inhibitors, NRTI)、免疫反應 (6-mercaptopurine, azathioprine, aminosalicylates, sulfonamides) 或是胰臟局部血管性水腫 (ACEI) 和小動脈血栓形成 (estrogen)。也可能是間接影響,如藥物導致高三酸甘油脂血症 (protease inhibitors) 和慢性高血鈣。以下個別介紹常見的藥物:
(一)
血管張力素轉化酶抑制劑(ACE inhibitor, ACEI),class Ib:
ACEI可能減少緩激肽 (bradykinin) 的降解,該成分的累積可能佳血管通透性、血管水腫,並造成膽管堵塞而使酵素和其他有毒物質滯留在胰臟內造成傷害。
(二)
HMG- CoA 還原酶抑制劑 (HMG-CoA reductase inhibitors, statins),class Ia:
Stains早期被認為可能透過橫紋肌溶解或是經CYP 3A4代謝成有毒代謝物而傷害胰臟,但根據Djibril et al於2023年發表在BMJ的美國全國性大型健保資料庫分析,7發現statins並無增加AP的風險,因此尚具爭議。
(三)
利尿劑,class Ia-Ib:
Loop diuretics可能減少細胞外液而減少胰臟血流量,導致缺血發炎,或是直接細胞毒性。Hydrochlorothiazide除了上述機制外,也可能造成高血鈣、高血脂與高副甲狀腺素,這些都是AP的誘發因子。
(四)
Valproic Acid, VPA,class Ia:8
確切機轉不明確,目前多認為VPA的毒性代謝物累積後會產生自由基攻擊胰臟組織,以及消耗胰臟的超氧化物歧化酶 (superoxide dismutase)、過氧化氫酶 (catalase) 和穀胱甘肽過氧化物酶 (glutathione
peroxidase) 進而產生過量自由基毒性。
(五)
抗生素:
n
Metronidazole (class Ia) 參與氧化還原反應,在有氧環境下產生過氧化氫 (hydrogen peroxide), 超氧化物 (superoxide) 以及自由基破壞胰臟細胞。
n
Trimethoprim/Sulfamethoxazole (class Ia),其中Sulfamethoxazole可能是主要導致AP的藥物,因為有許多磺胺類藥物導致AP的紀錄。確切的機轉不明,可能是過敏反應、免疫相關胰臟組織傷害。
n
Tetracyclines (class Ia-Ic) 如Tetracycline、Tigecycline、Minocycline、doxycycline可能直接對胰臟細胞造成毒性或是過敏反應。10
n
Erythromycin (class Ia) 是胃動素 (motilin) 受體的致效劑,可以刺激胃、小腸、膽囊和 Oddi 括約肌收縮。膽囊收縮促進膽汁分泌,但Oddi 括約肌收縮阻擋了出口,使膽汁回流到胰臟造成傷害11。Clarithromycin雖然證據較低 (class Ic) 但使用時仍需小心。
n
Ceftriaxone (class II) 相關案報告不多,但其導致AP可能有多重機轉。因為10-20%由膽汁排除,33-67%原型藥物由腎臟排出,當腎功能低下時有較多的比例轉由膽汁排出。加上本藥蛋白結合率85-95%,若病人白蛋白低下,則更多的游離態分子會由膽汁排除。過多的藥物在膽汁與鈣鹽結合型成溶解度低的ceftriaxone-calcium複合物,進而生成膽泥或假性結石 (Pseudolithiasis) 阻塞膽道出口,而使膽汁逆流進胰臟造成破壞。所幸本症狀停藥後是可逆的。12,13
(六)
抗病毒製劑:14
n
HIV可能本身就會直接對胰臟產生毒性,造成腺泡細胞萎縮,統計發現HIV陽性者AP發生率40%,比一般人的2%高許多。
n
蛋白酶抑制劑 (protease inhibitors),class Ib-IV,如nelfinavir, ritonavir, lopinavir/ritonavir-based
regimens被認為可能造成代謝問題,導致三酸甘油脂堆積,進而誘發AP。
n
其他如反轉錄酶抑制劑 (NRTI) lamivudine, didanosine (class
Ib); zidovudine, stavudine (class IV) 或非反轉錄酶抑制劑 (NNRTI) efavirenz皆有相關導致AP的案例。
三、急性胰臟炎的處置原則
1.
停止可疑藥品:若已排除其他常見因素如酒精、膽結石、高血鈣、高三酸甘油脂等因素,而高度懷疑藥物導致AP,應馬上停止可疑藥物,判斷嚴重程度後決定是否轉送加護病房。
2.
輸液:首先禁食以減少胰臟負擔,並給予輸液補充,避免因發炎血管擴張使器官灌流不足而壞死。最初的12-24小時內,輸液與發病率和死亡率的降低有關,輸液不足而血液濃縮與壞死性胰臟炎有關 (死亡率17%)。
3.
止痛:AP導致的疼痛可以使用鴉片類止痛藥,如口服Hydromorphone或注射fentanyl,尤其後者在腎功能惡化者也相對安全。雖然Morphine可能過度收縮Oddi括約肌造成膽汁逆流,惡化AP,部分資料建議使用pethidine,但本藥止痛效果不優於其他藥物,以及其活性代謝產物norpethidine
(normeperidine) 具有神經毒性。因此臨床上尚可見到使用morphine或tramadol,惟須注意AP症狀。
4.
營養:給予輸液補充熱量,輕度AP可在一周內恢復口服飲食,從低渣、低油和軟質食物開始嘗試。重度AP且預期無法在一周內恢復口服飲食者,建議裝鼻胃管給予元素配方營養,或是注射全靜脈營養
5.
抗生素:AP無須經驗性給予抗生素,以減少續發性黴菌感染。但組織壞死可能導致細菌感染 (20% AP會出現胰外感染,如血液、肺、尿道、膽道感染,通常發生於病程晚期,約莫第10天),15若臨床反應與檢驗數值顯示疑似細菌感染,或出現嚴重全身炎症反應綜合症(Systemic inflammatory response syndrome, SIRS),這時建議給與經驗性抗生素,需涵蓋常見腸道細菌,如E. coli, Pseudomonas, Klebsiella與Enterococcus,可單用carbapenems或quinolone、ceftazidime、cefepime擇一,搭配抗厭氧菌的metronidazole治療。若症狀無改善,則建議手術清除壞死組織、引流膿瘍,但症狀相對穩定者也可持續嘗試抗生素4周後再考慮手術介入。
6.
監測:需監測血氧飽和度與呼吸器的使用、維持尿排放量至少0.5-1 ml/kg/hr、維持電解質平衡、血糖 (胰臟炎可能減少胰島素分泌)
結論
臨床上導致AP的原因很多,膽結石、酗酒、抽菸、藥物、ERCP、高血鈣、高三酸甘油脂、感染、基因、自體免疫與外傷皆有可能,藥物雖只占其中的0.1-2%,一旦發病須盡速排除可能的誘發因子,並停止使用可疑藥物。因此了解哪些藥物容易誘發AP十分重要,請檢查病人是否正在使用class
Ia的藥物。而本案例使用的ceftriaxone雖不常見導致AP,但在腎功能不良,同時白蛋白低下者,仍應留意是否出現相關症狀與指數異常,趕緊停藥並考慮有無其他能使用的替代藥物。
參考資料
2.
Boxhoorn L, Voermans RP,
Bouwense SA, et al. Acute pancreatitis. Lancet. 2020;396:726-734
5.
Mark R. Jones, Oliver
Morgan Hall, Adam M. Kaye et al. Drug-Induced Acute Pancreatitis: A Review. Ochsner
J. 2015 Spring; 15: 45–51.
6.
Richárd Szmola, Miklós Sahin-Tóth.
Chymotrypsin C (caldecrin) promotes degradation of human cationic trypsin:
Identity with Rinderknecht's enzyme Y. Proc Natl Acad Sci U S A. 2007 Jul
3; 104: 11227–11232.
7.
Djibril M Ba, Yue Zhang, Vernon M
Chinchilli et al. Statins exposure and acute pancreatitis: a retrospective
cohort study using a large national insurance database.
BMJ
Open. 2023 Sep 27;13:e077591.
10.
Simcha Weissman, Muhammad Aziz, Ryan
B Perumpail et al. Ever-increasing diversity of drug-induced pancreatitis. World
J Gastroenterol. 2020 Jun 14; 26: 2902–2915.
11.
Marshall Stephen Tenenbein , Milton
Tenenbein. Acute pancreatitis due to erythromycin overdose. Pediatr
Emerg Care. 2005 Oct;21:675-6.
13.
Nozomu Nakagawa, Nobuaki Ochi,
Hiromichi Yamane et al. Ceftriaxone-associated pancreatitis captured on serial
computed tomography scans. Radiol Case Rep. 2018 Feb; 13:
43–46.
14.
Natalia Mejias Oliveira, Felipe
Augusto Yamauti Ferreira, Raquel Yumi Yonamine et al. Antiretroviral drugs and
acute pancreatitis in HIV/AIDS patients: is there any association? A literature
review. Einstein
(Sao Paulo). 2014 Jan-Mar; 12: 112–119.



沒有留言:
張貼留言